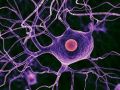
Американские ученые разработали простой, быстрый и надежный метод получения человеческих индуцированных нервных стволовых клеток (hiNSC). Отчет о работе опубликован в журнале Stem Cell Reports.
Человеческие нейроны необходимы для проведения множества нейробиологических и доклинических исследований. По понятным причинам добыть нервные клетки непосредственно из мозга невозможно (за исключением абортивного или трупного материала, однако это вызывает много этических вопросов, и такие клетки плохо культивируются на питательной среде). Поэтому в большинстве случаев ученые либо пользуются иммортализированными (бессмертными) клеточными линиями, подходящими далеко не для всех целей, либо получают нейроны из индуцированных плюрипотентных стволовых клеток (iPSC). Последний метод также имеет ряд недостатков: он занимает много времени, требует множества сложных в выполнении промежуточных стадий и приводит к неоднородной дифференцировке итоговых нейронов.
Чтобы преодолеть эти сложности, сотрудники Университета Тафтса использовали прямое перепрограммирование фибробластов кожи и стволовых клеток жировой ткани в hiNSC. Для этого они с помощью обезвреженного вируса ввели в клетки гены нескольких факторов транскрипции, управляющих дифференцировкой клеток (OCT4, KLF4, SOX2 и c-MYC). Причем работа этих генов происходила без встраивания в геном, что дало возможность впоследствии удалить посторонний генетический материал. После этого клетки поместили на среду с питающим слоем мышиных эмбриональных фибробластов и получили растущие колонии hiNSC.
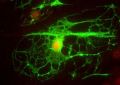
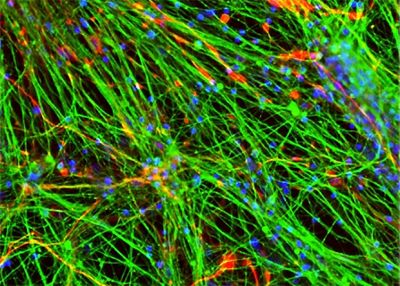
После этого колонии превратили в суспензию из отдельных клеток и поместили их на питательную среду. Уже на четвертый день клетки начали спонтанно дифференцироваться в зрелые нейроны (на поверхности которых появились характерные биомаркеры и белки, необходимые для формирования синапсов) и глиальные клетки (вспомогательные клетки нервной ткани). Причем соотношением типов клеток можно было управлять, меняя состав питательной среды. Кроме того, полученные клеточные линии hiNSC хорошо выдерживали множественные пересевы на питательных средах и хранились в замороженном виде.
После восьминедельной инкубации на специальных средах полученные из hiNSC нейроны демонстрировали все признаки зрелости: поддерживали мембранный потенциал от −50 до −70 милливольт, генерировали спонтанные и вызванные потенциалы действия и реагировали на добавление фармпрепаратов, в частности ингибиторов и стимуляторов тормозных ГАМК-рецепторов.
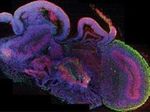
В следующем эксперименте ученые ввели hiNSC в нервную трубку куриных эмбрионов. В зависимости от непосредственного окружения клетки дифференцировались в разные типы нейронов и встроились как в центральную нервную систему, так и в периферическую нервную ткань формирующейся конечности, не теряя своей формы и функции в присутствие клеток других тканей.
В заключение исследователи поместили hiNSC в разработанную ими модель мозга, которая была сделана из покрытого ламинином шелкового каркаса и коллагенового геля. Через три недели у дифференцированных нейронов появились длинные отростки и наблюдалась активная электрическая деятельность, что свидетельствует об их функциональности.
Исследователи отмечают, что их методика позволяет стабильно и быстро получать hiNSC для широкого круга лабораторных экспериментов, однако в текущем виде не готова к клиническому применению, поскольку требует использования животных материалов. Ученые продолжают совершенствовать разработанную технологию и планируют модифицировать ее для моделирования различных заболеваний мозга.
«Быстрая дифференцировка клеток ускоряет проведение исследований. Другие модели мозга, находящиеся в стадии разработки, часто требуют месяцев для формирования аналога нервной ткани. При использовании нашего матрикса клетки уже через несколько недель формируют нейронные сети», — отметила первый автор работы Дана Кэирнс (Dana Cairns).
В последнее время нейробиологи достигли немалых успехов в манипуляциях с нервными клетками. Так, например, они научились управлять нервными клетками с помощью радиоволн, «сваривать» их лазером, создавать искусственные нейронные ансамбли памяти и печатать аналог мозговой ткани на 3D-принтере.