Американские и испанские ученые обнаружили, что временное «включение» факторов, преобразующих зрелые клетки в стволовые, способно частично обратить признаки старения и продлить жизнь у мышей с моделью преждевременного старения (прогерии) и пожилых обычных животных. Результаты работы опубликованы в журнале Cell.
Ряд предыдущих работ привели к фундаментальному открытию, что индукция совместной экспрессии четырех тесно связанных с основными этапами жизненного цикла клетки факторов транскрипции: Oct4, Sox2, Klf4 и c-Myc (OSKM, или факторы Яманаки), переводит зрелые соматические клетки в плюрипотентные стволовые путем эпигенетической регуляции клеточных процессов. Эти клетки, названные индуцированными плюрипотентными стволовыми клетками (iPSC), подобно эмбриональным могут дифференцироваться практически в любые клетки организма. За их получение Синъя Яманака в 2012 году удостоился Нобелевской премии.
Однако попытки запустить тот же механизм в живых организмах, а не клеточных культурах, могут привести к печальным последствиям: во-первых, перевод большого числа зрелых функциональных клеток в плюрипотентные неминуемо приведет к отказу органов, а во-вторых, бурная пролиферация стволовых клеток вызовет развитие злокачественных опухолей из эмбриональных тканей — тератом.
На первом этапе экспериментов ученые применили эту методику к культуре фибробластов мышей с прогерией — генетическим дефектом белка ламина А, который приводит к быстрому старению организма (люди с этим заболеванием умирают от старости в возрасте около 10 лет). Введение кассеты OSKM с последующей обработкой доксициклином в течение от двух до четырех дней вызывало процессы омоложения клеток: подавляло стрессорные гены сигнального пути p53, снижало продукцию активных форм кислорода митохондриями, восстанавливало уровни эпигенетических модификаций H3K9me3 и H4K20me3, отвечающих за состояние гетерохроматина, и уменьшало число дефектов ДНК. При этом клетки оставались дифференцированными: экспрессировали маркер фибробластов Thy1 и не вырабатывали маркер плюрипотентности Nanog.
Аналогичных результатов удалось добиться на культурах искусственно состаренных длительным ростом на питательной среде здоровых фибробластов мыши и человека.
После этого метод опробовали на живых мышах с прогерией, которым ввели одну копию кассеты. Постоянная индукция экспрессии OSKM приводила к резкой потере массы тела и смерти спустя в среднем четыре дня. Назначение доксициклина двухдневными циклами с пятидневным перерывом не производило подобных эффектов даже после 35 циклов. При этом у животных после шести недель терапии наблюдалось значительное уменьшение признаков старения кожи, внутренних органов и иммунной системы, а их средняя продолжительность жизни увеличилась примерно на 30 процентов. Такая же цикличная индукция, проводимая мышам с двумя копиями OSKM, приводила к развитию тератом, чего у животных с одной копией не наблюдалось.
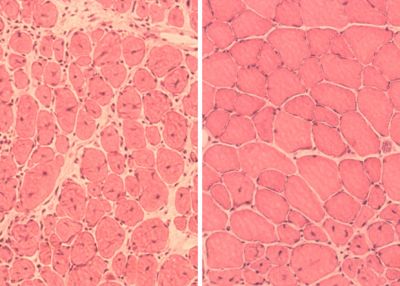
Применение цикличной индукции OSKM в мышцах и поджелудочной железе нормальных пожилых мышей вызвало частичное восстановление возрастной утраты массы и функций и способности к регенерации этих органов.
«Наша работа показала, что старение не обязательно должно проходить в одном направлении. Оно обладает пластичностью, и при осторожной модуляции его можно обратить», — подытожил старший автор публикации Хуан Карлос Исписуа Бельмонте (Juan Carlos Izpisua Belmonte).
Продление здоровой жизни и борьба со старением интересует многих ученых. Значительные успехи в этой области, правда, в экспериментах на животных, достигнуты путем ограничения потребляемых калорий, ингибирования клеточного сигнального пути mTOR рапамицином, назначения никотинамидрибозида, фармакологической «очистки» организма от старых клеток и пересадки половых желез молодых особей. Определенные перспективы имеют также эксперименты со стволовыми клетками и манипуляции с теломерами.
Олег Лищук